<백반의 합성>
묽은 황산 용액으로 재결정하는 이유
- 백반은 알루미늄과 칼륨의 복합 황산염이다. 중성에서 백반을 결정시키려고 중화하면 수산화알루미늄의 침전이 생겨, 결정이 오염되고 깨끗한 결정을 얻을 수 없다.
- 황산이 약간 남아 있으면 가수분해는 더 이상 진행되지 않고 알루 미늄은 모두 이온상태로 존재하기 때문에 결정을 만들면 깨끗한 결정을 얻을 수 있다.
<황산사암산구리의 합성>
<나일론의 합성>
- 나일론: 최초) 나일론: 나일론 6 이름 섬유 대량 생산
역사 가장 오래된 합성 섬유, 거미줄보다 가늘고 마찰에 강함
인장강도가 다른 섬유보다 월등
젖어도 강도 변화 없음, 탄력성 보온성
의복~산업용: 광범위하게 사용
- 고분자: 수많은 저분자량 단위들이 화학결합으로 연결되어 이루어진 분자량 10,000g/mol 이상의 물질
중합반응: 작은 분자들(단위체)이 반복적으로 합쳐져서 고분자를 형성하는 과정
단위체-> 두 개의 단량체 결합된 다이머 형태
-

<얇은 크로마토그래피>





<용해도 곱 상수의 결정>
용해도: 용매 100g에 녹아 있는 용질의 g수
몰 용해도: 포화용액 1L 안에 있는 용질의 몰 수 [mol/L]
용해도-> 평형의 위치, 특정 온도에서 특정한 용해도 가짐, 공통이온의 존재, 압력 영향 받음
용해도 곱 상수-> 평형상수 개념, 주어진 온도에서 주어진 고체에 대한 단 하나의 값만을 가짐.


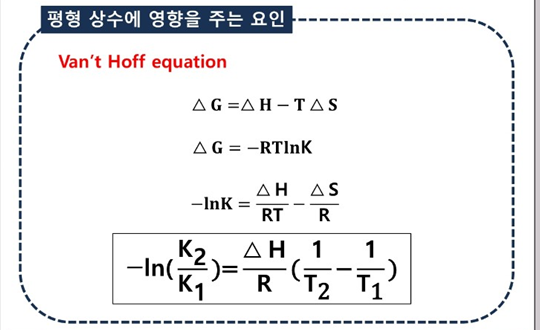
<화학 평형 상수의 결정 >

평형 상수 (K)
: 특정 온도에서 평형 이루고 있을 떄 반응물과 생성물의 농도 관계
반응 지수 (Q)
: 특정 온도에서 반응이 진행되고 있는 현재 상태의 반응물과 생성물의 농도관계 나타낸 상수
평형 도달 -> Q=K


<음이온의 정성 분석>
화학 분석: 물질의 구성 성분, 성분비 알기 위한 수단
- 정성 분석: 물질을 이루고 있는 각 성분 조사
- 정량 분석: 물질을 이루고 있는 각 성분의 양적 관계 조사
양이온의 분족: 공통성 기반-> 양이온 1족~6족 분리
분족 시약-> 양이온) 침전 반응, 용해시키는 방법을 통해 다른 이온들로부터 쉽게 분리
제 1족 양이온
제1족
d-HCl (분족시약)
염화물(침전형)
소속 양이온 Ag 2+, Pb 2+, Hg 2+
-> 제 1족 양이온은 Cl-와 반응-> 염화물 침전 생성
제 2족 양이온
제 2족
CH3CSNH2(+HCl)
황화물
소속 양이온 구리족 Bi3+, Cu2+, Cd2+
주석족 As2+, 4+ Sn 2+, 4+ Sb 3+, 5+
-> 산성 용액에서 S2-와 반응-> 황화물 침전 생성
대표 반응: M2+ + CH3CSNH2 + H2O -> MS(s) + CH3CONH2 + 2H+
생성물: Bi2S3(s) 갈색
CuS(s) 검은색
SnS2(s) 노란색
Sb2S3(s) 오렌지색
점적분석: 반점분석, 미량분석의 종류,소량의 시료 용액에 적당한 시약 떨어뜨려서 시료에 포함된 물질 검출
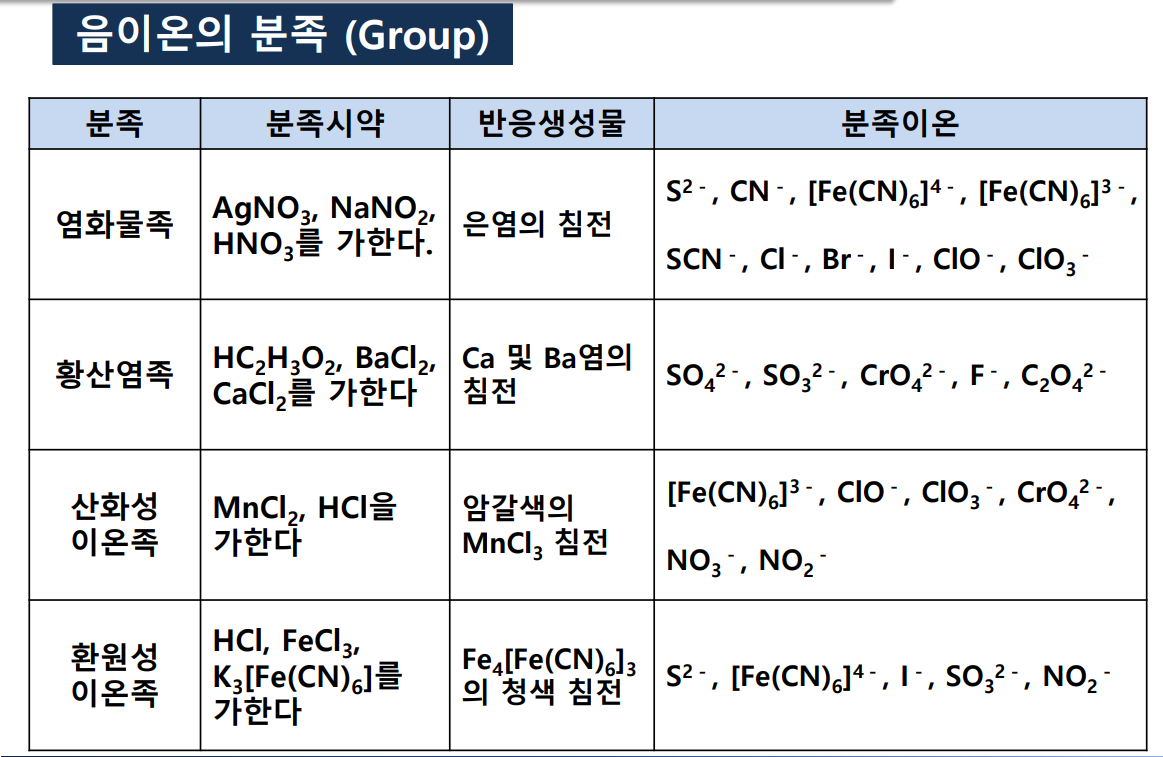
음이온의 분족

<그레이엄의 확산 법칙>
확산: 밀도 차이나 농도 차이에 의해 분자들이 스스로 운동하여 액체나 기체 속으로 퍼져 나가는 현상
확산( 용질)
삼투: 반투과성 막 기준, 용매의 입자가 저농도 용액에서 고농도 용액으로 이동
(용매 기준)
확산: 사방으로 퍼지고
분출: 방향성 가짐
분출: 작은 구멍을 통하여 기체가 다른 장소로 이동하는 것
기체 분자 운동론
-전제조건
1. 기체 상태에서는 분자 사이의 거리가 멀고, 운동에너지가 크기 때문에 분자들이 매우 빠르게, 끊임없이 운동
2. 기체 분자 모든 방향으로 무질서하게 직선 운동, 기체가 운동하면서 벽면과 충돌-> 압력 나타냄
3. 기체 분자: 완전 탄성체-> 충돌시 완전 탄성 충돌함
충돌 시 에너지의 손실 없음, 충돌 전 후 운동에너지 변함 없음
4. 기체를 이루는 분자의 부피는 기체가 차지하는 공간전체의 부피에 비해 아주 작아서 무시할 수 있음. 분자간의 인력, 반발력 작용 안함
5. 기체 분자: 평균 운동 에너지는 절대 온도 (T)에 정비례, 기체 분자의 크기, 모양, 종류 관계 없음
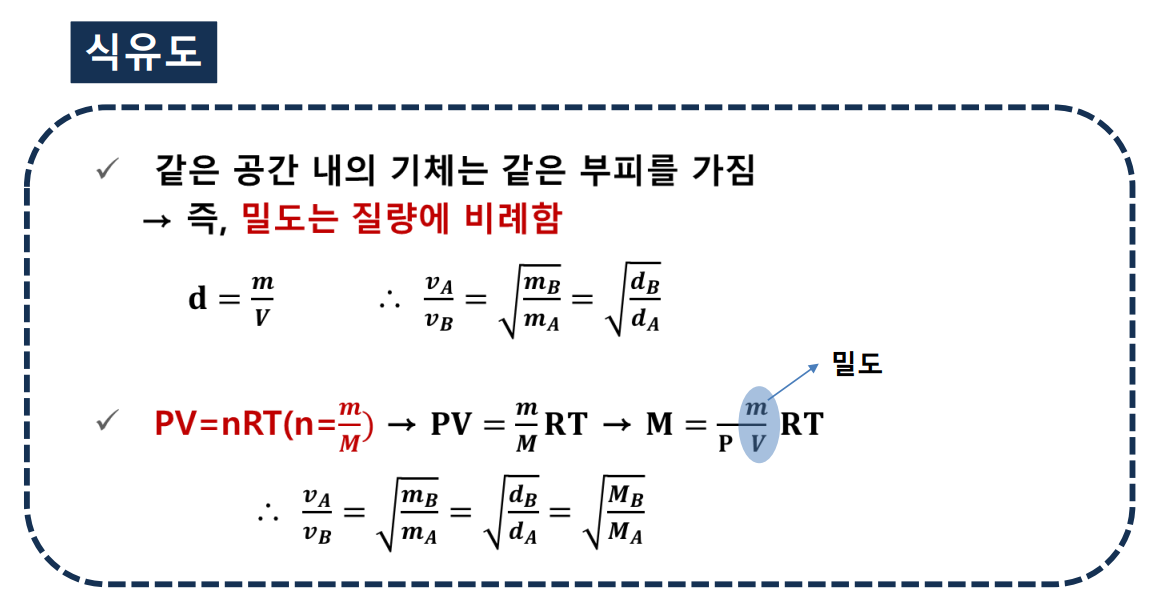
그레이엄의 확산법칙
:일정한 온도와 압력 상태에서 기체의 확산 속도는 기체분자량의 제곱근에 반비례


<르샤트리에의 원리>
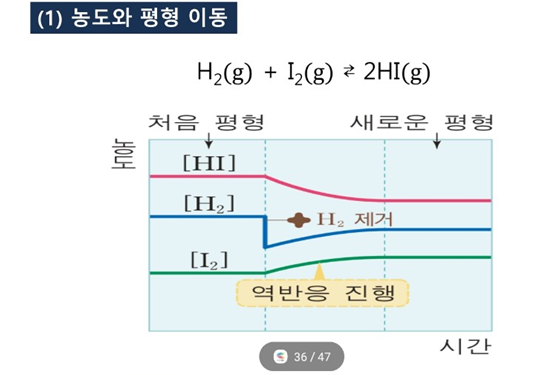
화학평형: 가역반응에서 정반응 속도와 역반응 속도 같아져 겉보기에 화학 반응이 일어나지 않는 것처럼 보이는 상태
평형상수의 특징

평형 이동의 법칙 (르 샤틀리에의 원리)
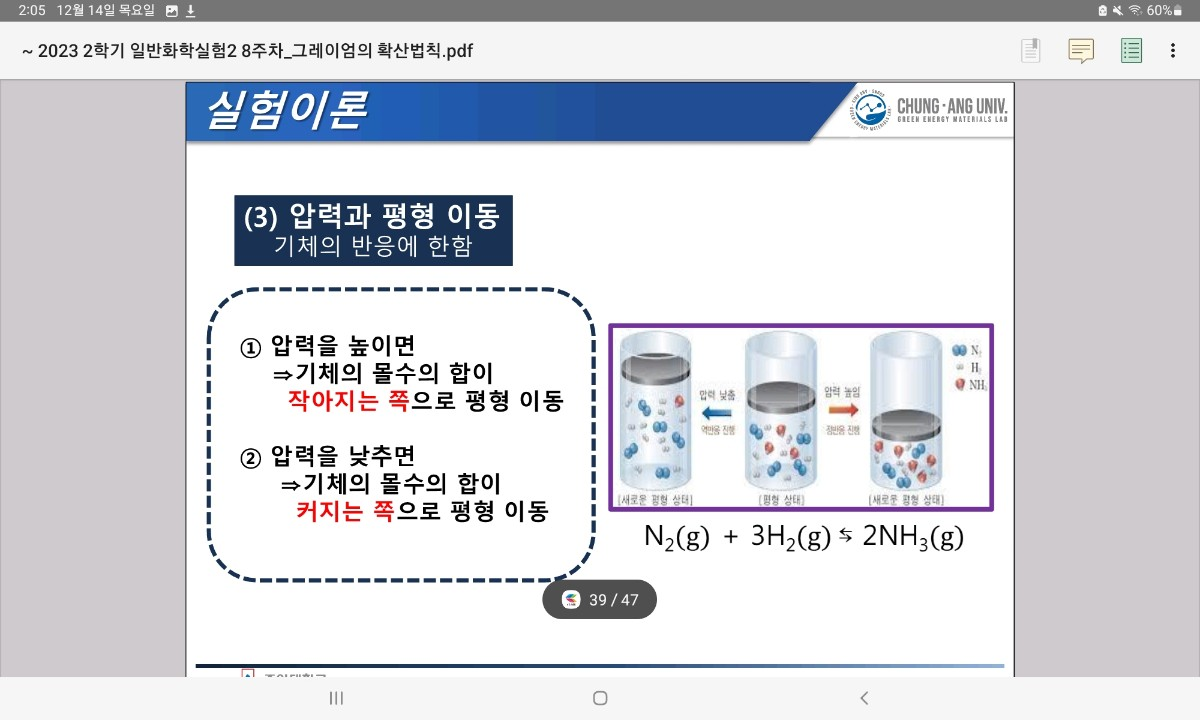
: 가역 반응이 평형 상태에 있을 때, 농도, 온도, 압력 중 어느 하나를 변화시키면 반응은 그 변화를 감소시켜 주려는 쪽으로 진행하여 새로운 평형 상태에 도달
(농도, 온도, 압력)

'전공 일기' 카테고리의 다른 글
| Physical Chemistry of Materials (0) | 2024.04.17 |
|---|---|
| 첨단소재과학-chap. 2 (0) | 2024.04.01 |
| 일반물리실험 개념 총정리 (0) | 2023.12.11 |
| 일반화학 15장 (0) | 2023.11.06 |
| 첨단소재공학입문-차세대 에너지 저장 장치를 위한 신규 나노소재 개발 (0) | 2023.10.23 |